細胞形態・表現型解析による分子プロファイリング
Evaluation of the test compounds by cell morphology and phenotypic screening system
(担当:田代 悦)
(Members in charge: Etsu Tashiro)
本系は、上皮間葉転換・オートファジー・細胞運動・神経保護作用など各種生理イベントのモニタリングに適した細胞株を用いた評価系である。これらの評価系は、細胞毒性を伴わない表現型解析であることから、細胞パネルで増殖阻害効果が現れない化合物の評価にも有効である。
The aim of this cell morphology and phenotypic screening system is to evaluate the activity of the test compound against epithelial-mesenchymal transition (EMT) regulation, autophagy regulation, wound healing inhibition, or neuroprotection. Since these assay systems can evaluate the activity of the test compound in cytotoxicity-independent manner, they are also useful for the compounds that do not show any positive effects using cell line panel.
- (A)細胞運動阻害活性評価系 (Wound healing assay)
- (B)上皮間葉転換制御活性評価系 (EMT regulation assay)
- (C)オートファジー制御活性評価系 (Autophagy regulation assay)</a >
- (D)神経保護活性評価系 (Neuroprotection assay)
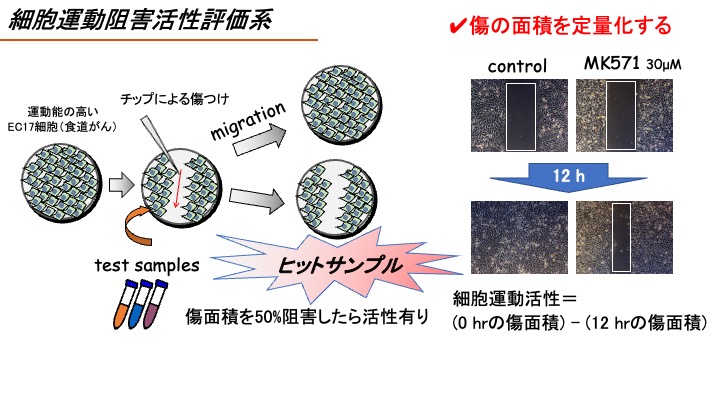
(A)細胞運動阻害活性評価系
Wound healing assay
【概要】
Introduction
細胞運動は、多くの生命現象において必須の細胞機能であり、がんの浸潤・転移においても重要な役割を担っている。したがって、細胞運動を阻害する物質は転移機構解明の有用なバイオプローブとして期待される。そこで本系では、遊走能の高いヒト食道がんEC17細胞を用いて細胞運動活性を評価する。
Cell migration is a fundamental step for various biological phenomena, especially cancer cell invasion and metastasis. Therefore, compounds that inhibit cell migration would be useful bioprobes for elucidating the mechanism of cancer cell invasion. Therefore, in this assay system, we evaluate the activity of the test compound to inhibit cell migration by using human esophageal carcinoma EC17 cells that have high migration activity (Takemoto Y. et al. (2005) Chem. Biol., vol. 12, p1337).
【方法】
Methods
EC17細胞を12ウェルプレートに蒔き、培養する。そしてコンフルエントの状態になったEC17細胞にマイクロチップでひっかき傷を付け、模擬的な傷を作る。続いてFBS 1%の培地に交換すると共に検体を添加し、12時間後に埋まる傷をどれだけ阻害するのか、傷の面積を定量化することで評価する。なお、陽性対照にはMK571(30 μM)(Magi S. et al. Sci Rep. (2012) vol.2, p823)を用いる。
A confluent monolayer of EC17 cells in a 12-well plate is scratched with a micropipette tip to create a cell-free zone as reported previously (Takemoto Y. et al. (2005) Chem. Biol., vol. 12, p1337), and then the test compound is added. After 12 hrs, the wound areas are observed under microscope and quantified using ImageJ software. We use MK571 (30 μM) as a positive compound that inhibits cell migration.
【活性の評価】
Evaluation of the activity
検体は、まずは10μMの濃度で細胞に添加し、傷の面積を定量化する。すなわち細胞運動活性=(傷つけ0時間の傷面積)—(傷つけ12時間後の傷面積)を測定し、検体未添加時の値を100%として数値化する。細胞運動活性を50%以上阻害した検体についてはさらに濃度を下げて評価し(0.1μM, 1μM, 10μM)、有効濃度EC50値を算出する。
The test compounds are added at 10 μM. We evaluate the inhibitory activity of the test compounds for cell migration by calculating the values of Migration activity = (scratch area at 0 hr) – (scratch area at 12 hr). If the test compound inhibited cell migration over 50%, the test compounds would be added at 0.1, 1, or 10 μM and we calculate the Effective concentration (EC50).
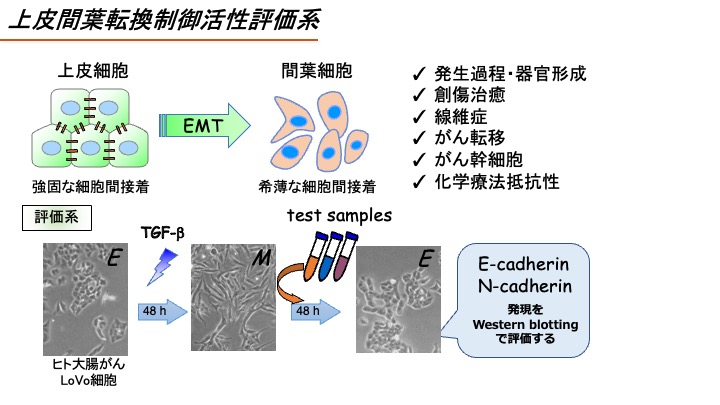
(B)上皮間葉転換制御活性評価系
EMT regulation assay
【概要】
Introduction
EMT(上皮間葉転換)は、上皮性のがん細胞が間葉系細胞の表現型を獲得する現象をいう。近年、EMTはがん転移や薬剤耐性と関連することが明らかとなってきたが、そのメカニズムについてはまだまだ不明な点が多い。したがって、EMT制御物質はそれらのメカニズム解明の有用なバイオプローブになる。ここではEMTを起こしたがん細胞を上皮細胞の表現型に戻す活性(MET促進活性)に着目し、テスト化合物のMET促進活性を評価する。
Epithelial-Mesenchymal transition (EMT) is a process by which epithelial cells lose their cell polarity and cell-cell adhesion to become mesenchymal cells. Recent studies have suggested that EMT is involved in cancer cell migration and drug resistance, however, the regulatory mechanism of EMT has been still unclear. Therefore, the compounds modulating EMT would be a useful bioprobe for investigating the mechanism of EMT. In this assay system, we will evaluate the activity of the test compounds to reverse the mesenchymal phenotype to epithelial phenotype (MET-inducing activity).
【方法】
Methods
TGF-β刺激によるEMT誘導能の高いヒト大腸がんLoVo-KO細胞をTGF-β刺激(1 ng/ml)すると48時間後には上皮マーカーとして知られるE-cadherinの発現減少と間葉マーカーとして知られるN-cadherinの発現上昇が見られ、EMTが誘導される。そこでEMTが誘導されたLoVo-KO細胞に検体を添加し、さらに48時間培養、TGF-β刺激によるE-cadherin発現減少の回復と、N-cadherinの発現上昇の阻害を調べる.なお、陽性対照にはTGF-βRI阻害剤であるSB431542(1 μM)を用いる。 具体的には、LoVo-KO細胞を6ウェルプレートに蒔き、24時間後にFBS 1%の培地に交換すると共にTGF-β(1 ng/ml)を添加する。48時間後に検体を添加し、さらに48時間後に細胞を回収する。その後E-cadherin抗体とN-cadherin抗体を用いたウェスタンブロットを行い、E-cadherin発現量回復率およびN-cadherin発現量阻害率を評価する。
A subline of human colorectal carcinoma LoVo (LoVo-KO) cells are treated with 1 ng/ml TGF-β for 48 hrs, then, the cells are treated with the test compounds for another 48 hrs. Cells are collected and subjected to Western blotting using anti-E-cadherin and N-cadherin antibodies as previously reported (Tashiro E. et al. (2016) Biochem. Biophys. Res. Commun., vol. 477, p801). The activity of the test compounds to regulate EMT is evaluated by calculating the intensity of bands corresponding to E-cadherin and N-cadherin using ImageJ software.
【活性の評価】
Evaluation of the activity
検体は、まずは10 μMの濃度で細胞に添加し、TGF-β刺激によるE-cadherin発現減少を30%以上回復させるか、TGF-β刺激によるN-cadherin発現上昇を50%以上阻害するかを評価する。そして、ここでヒットした検体についてはさらに濃度を下げて評価し(0.1 μM、1 μM,10 μM)、有効濃度EC30 (E-cadherin) もしくはEC50 (N-cadherin) 値を算出する。
The test compounds are added at 10 μM. We will judge the test compound as positive if the test compound canceled TGF-β-induced decrease of E-cadherin expression and increase of N-cadherin expression over 30% and 50%, respectively. If the test compound was judged as positive, the test compounds would be added at 0.1, 1, or 10 μM and we calculate the EC30 (E-cadherin) and EC50 (N-cadherin).
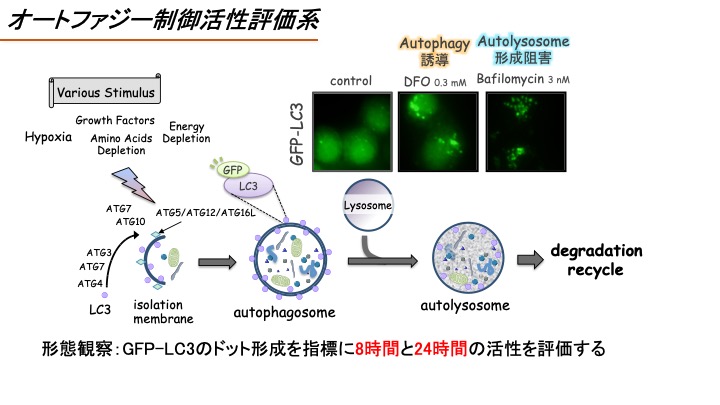
(C)オートファジー制御活性評価系
Autophagy regulation assay
【概要】
Introduction
オートファジーは飢餓時における栄養確保や異常タンパク質の分解除去のため、細胞が自らの細胞内成分を分解するシステムであり、①隔離膜による細胞質成分やオルガネラの取り込み、②隔離膜同士の融合によるオートファゴソーム形成、③オートファゴソームとリソソームの融合によるオートリソソーム形成、そして、④オートリソソーム内の内包物の分解、によって成り立っている。またオートファジーは、がんや神経変性疾患など様々な疾患においてその活性化や機能異常が観察されることから、オートファジー制御物質はこれら疾患の発症機構や制御機構解明の有用なバイオプローブとなる。オートファジーを検出するためには、オートファゴソームに集積するタンパク質LC3に緑色蛍光タンパク質GFPを連結させたGFP-LC3をモニタリングする系が広く用いられている。そこで本系でも、HeLa細胞にGFP-LC3を安定的に発現させたGFP-LC3/HeLa細胞を用い、GFP-LC3の蛍光シグナルをモニタリングすることでオートファジー制御活性を評価する(Sasazawa Y. et al. ACS Chem Biol. (2012) vol.7, p892)。
Cell migration is a fundamental step for various biological phenomena, especially cancer cell invasion and metastasis. Therefore, compounds that inhibit cell migration would be useful bioprobes for elucidating the mechanism of cancer cell invasion. Therefore, in this assay system, we evaluate the activity of the test compound to inhibit cell migration by using human esophageal carcinoma EC17 cells that have high migration activity (Takemoto Y. et al. (2005) Chem. Biol., vol. 12, p1337).
【方法】
Methods
GFP-LC3を安定的に発現させたGFP-LC3/HeLa細胞に検体を添加する。8時間後と24時間後にGFP-LC3の蛍光シグナルを蛍光顕微鏡にて観察し、GFP-LC3がドット状に観察されればオートファジー誘導剤もしくはオートリソソーム形成阻害剤として陽性判定とする。なお、オートファジー誘導剤としての陽性対照にはRapamycin(10 μM)を、オートリソソーム形成阻害剤としての陽性対照にはBafilomycin A1(10 nM)を用いる。 具体的にはGFP-LC3/HeLa細胞を12ウェルプレートに蒔き、24時間後に検体を添加する。そして8時間後と24時間後にGFP-LC3の蛍光シグナルを顕微鏡観察にて撮影し、その画像から形成したGFP-LC3のドット面積をImage-Jにて定量化する。
HeLa/GFP-LC3 cells are treated with the test compounds, then, after 8 or 24 hrs treatment, the puncta of GFP-LC3 are observed under a fluorescence microscope. If the test compound increased the number of the GFP puncta, the test compound would be judged as autophagy inducer or autophagy inhibitor. We use bafilomycin A1 (10 nM) as a positive compound that inhibits autophagy. The GFP-positive puncta area is calculated using ImageJ software.
【活性の評価】
Evaluation of the activity
検体は、まずは10 μMの濃度で細胞に添加し、GFP-LC3がドット状に観察され、且つGFP-LC3のドット面積が検体未処理サンプルに比べて有意に2倍以上増加するのかを評価する。そして、ここでヒットした検体についてはさらに濃度を下げて評価し(0.1 μM、1 μM,10 μM)、有効濃度を明らかにする。
The test compounds are added at 0.1, 1, or 10 μM. We will judge the test compound as positive if the test compound significantly increased GFP puncta over 2-fold. If the test compound was judged as positive, the test compounds would be added at 0.1, 1, or 10 μM and we evaluate the effective concentrations to regulate autophagy.
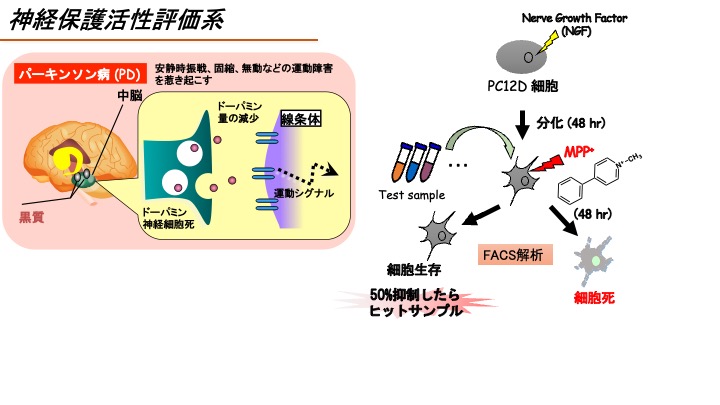
(D)神経保護活性評価系
Neuroprotection assay
【概要】
Introduction
神経細胞死は、パーキンソン病・アルツハイマー病・ハンチントン病など神経変性疾患共通の表現型である。これまで、パーキンソン病患者の脳ではミトコンドリアの機能障害が見られること、またミトコンドリア障害を引き起こすMPTPをサルやラットに投与するとパーキンソン病の神経病理学的特徴を示すこと、さらにMPTPの代謝産物であるMPP+を神経細胞に添加すると細胞死が誘導されることから、MPTPおよびMPP+はパーキンソン病を模倣する化合物として使用されている。そこで本評価系でも、MPP+による神経細胞死に着目し、テスト化合物の神経保護活性を評価する。
Neuronal cell death is a common feature of neurodegenerative diseases such as Parkinson’s disease, Alzheimer’s disease, and Huntington’s disease. Among them, mitochondrial dysfunction has been observed in the brains of Parkinson’s patients. Moreover, administration of MPTP, which is known to cause mitochondrial dysfunction, to monkeys and rats shows neuropathological characteristics of Parkinson’s disease. In addition, treatment of MPP+, a metabolite of MPTP, to neuronal cells is reported to induce cell death. Therefore, MPP+ are used to mimic Parkinson’s disease in vitro. In this assay system, the neuroprotection activity of the test compounds was assessed by their suppressive activities against MPP+-induced neuronal cell death.
【方法】
Methods
ラット副腎髄質褐色細胞腫PC12D細胞をNGF(100 ng/ml)存在下で2日間培養すると神経様細胞に分化する。そこにMPP+(0.3 mM)を添加すると48時間後に細胞死が誘導される(Fujimaki T. et al. PLoS ONE (2014) vol.9, e100395).そこで、MPP+による神経細胞死抑制活性をFACS解析にて評価する。なお、陽性対照には神経保護作用が報告されているkaempferol(30 μM)を用いる。 具体的には、PC12D細胞を12ウェルプレートに播種し、上記の方法で神経様細胞に分化させる。検体およびMPP+を含む培地に交換、48時間後に細胞を回収したのちPI染色を行い、フローサイトメーターにてアポトーシスを示すsubG1期を測定する。
NGF-differentiated PC12D cells are treated with the test compounds together with 0.3 mM MPP+. After 48 hrs treatment, the cells are stained with propidium iodide and the DNA contents are analyzed by flow cytometer according to a previous report (Fujimaki T. et al. (2014) PLoS ONE, vol. 9, e100395). Kaempferol is used as a positive control, because kaempferol at 30 μM has been shown to protect MPP+-induced neuronal cell death.
【活性の評価】
Evaluation of the activity
検体は、まずは10 μMの濃度で細胞に添加し、傷の面積を定量化する。すなわち細胞運動活性=(傷つけ0時間の傷面積)—(傷つけ12時間後の傷面積)を測定し、検体未添加時の値を100%として数値化する。細胞運動活性を50%以上阻害した検体についてはさらに濃度を下げて評価し(0.1 μM、1 μM,10 μM)、有効濃度EC50値を算出する。
NGF-differentiated PC12D cells are treated with the test compounds (10 μM) together with 0.3 mM MPP+ for 48 hrs, and the neuroprotection activity of each test compound is evaluated by calculating the percentage of sub-G1 peak in FACS data. We will judge the test compound as positive if the test compound suppressed MPP+-induced neuronal cell death over 50%. If the test compound was judged as positive, the test compounds would be added at 0.1, 1, or 10 μM and we calculate the EC50.